Chuyên đề Lập phương trình hóa học
Từ phía giáo viên:
- Chưa thực sự quan tâm đến tất cả các đối tượng học sinh trong cả lớp mà chỉ chú trọng một số em học khá - giỏi.
- Một số giáo viên chưa nhiệt tình và thiếu tính kiên trì. Chưa động viên và khen thưởng kịp thời đối với những tiến bộ của học sinh nên chưa tạo được cho học sinh không khí học tập thân thiện.
- Khả năng phối kết hợp của giáo viên bộ môn với giáo viên chủ nhiệm và phụ huynh học sinh chưa cao.
- Chưa đổi mới phương pháp dạy học, kiểm tra đánh giá phù hợp với từng đối tượng học sinh nên đánh giá học sinh chưa chính xác và nghiêm túc, vì vậy chưa kích thích được tính tự học, chủ động, sáng tạo, tự chiếm lĩnh kiến thức của học sinh.
Từ gia đình và xãhội.
- Một số phụ huynh chưa quan tâm đến việc học tập của con em mình mà giao phó việc học tập của con em họ cho nhà trường, không quan tâm quản lý thời gian cũng như việc học tập của con em mình ở nhà dẫn đến tình trạng một số em còn lơ là trong học tập, ý thức rèn luyện đạo đức chưa tốt.
- Sự phát triển bùng nổ của công nghệ thông tin cùng với internet với các dịch vụ vui chơi, giải trí hấp dẫn đã lôi cuốn học sinh.
Bạn đang xem tài liệu "Chuyên đề Lập phương trình hóa học", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
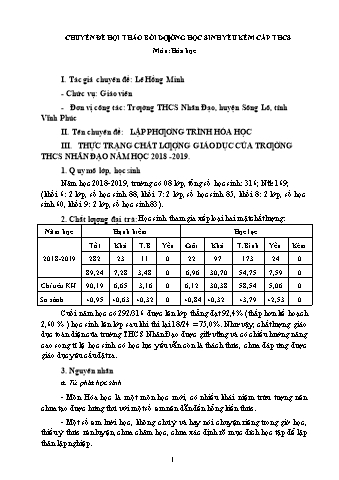
CHUYÊN ĐỀ HỘI THẢO BỒI DƢỠNG HỌC SINH YẾU KÉM CẤP THCS Môn: Hóa học I. Tác giả chuyên đề: Lê Hồng Minh - Chức vụ: Giáo viên - Đơn vị công tác: Trƣờng THCS Nhân Đạo, huyện Sông Lô, tỉnh Vĩnh Phúc II. Tên chuyên đề: LẬP PHƢƠNG TRÌNH HÓA HỌC III. THỰC TRẠNG CHẤT LƢỢNG GIÁO DỤC CỦA TRƢỜNG THCS NHÂN ĐẠO NĂM HỌC 2018 -2019. 1. Quy mô lớp, học sinh Năm học 2018-2019, trường có 08 lớp, tổng số học sinh: 316; Nữ: 169; (khối 6: 2 lớp, số học sinh 88, khối 7: 2 lớp, số học sinh 85, khối 8: 2 lớp, số học sinh 60, khối 9: 2 lớp, số học sinh 83). 2. Chất lƣợng đại trà: Học sinh tham gia xếp loại hai mặt chất lượng: Năm học Hạnh kiểm Học lực Tốt Khá T.B Yếu Giỏi Khá T.Bình Yếu Kém 2018-2019 282 23 11 0 22 97 173 24 0 89,24 7,28 3,48 0 6,96 30,70 54,75 7,59 0 Chỉ tiêu KH 90,19 6,65 3,16 0 6,12 30,38 58,54 5,06 0 So sánh +0,95 +0,63 +0,32 0 +0,84 +0,32 +3,79 +2,53 0 Cuối năm học có 292/316 được lên lớp thẳng đạt 92,4% (thấp hơn kế hoạch 2,60 % ) học sinh lên lớp sau khi thi lại 18/24 = 75,0%. Như vậy, chất lượng giáo dục toàn diện của trường THCS Nhân Đạo được giữ vững và có chiều hướng nâng cao song tỉ lệ học sinh có học lực yếu vẫn còn là thách thức, chưa đáp ứng được giáo dục yêu cầu đặt ra. 3. Nguyên nhân a. Từ phía học sinh: - Môn Hóa học là một môn học mới, có nhiều khái niệm trừu tượng nên chưa tạo được hứng thú với một số em nên dẫn đến hổng kiến thức. - Một số em lười học, không chú ý và hay nói chuyện riêng trong giờ học, thiếu ý thức rèn luyện, chưa chăm học, chưa xác định rõ mục đích học tập để lập thân lập nghiệp. 1 - Giáo viên phải xác định được những kiến thức, kỹ năng mà học sinh cần phải đạt cũng như các tình huống có thể nảy sinh từ đó giáo viên lựa chọn được các phương pháp dạy học phù hợp. - Phải thường xuyên thay đổi phương pháp, hình thức dạy học linh hoạt đa dạng trong mỗi tiết học. Tạo không khí học tập vui vẻ, thoải mái, thân thiện cho học . - Lựa chọn bài tập phù hợp với đối tượng học sinh, sao cho đối tượng yếu kém nếu thực sự cố gắng cũng hoàn thành được yêu cầu của giáo viên giao cho. - Giáo viên phải nhiệt tình, nhẫn nại, không nôn nóng, sốt ruột và thiếu tin tưởng vào sự tiến bộ của học sinh. - Tổ chức cho các em học sinh có học lực khá, giỏi giúp đỡ, kèm các em có học lực yếu, kém. - Giúp các em biết lựa chọn cách học và biết cách ghi nhớ, ghi nhớ có chon lọc để khắc sâu kiến thức. - Cho học sinh làm việc nhiều hơn, tăng cường bài tập vận dụng kiến thức, bài tập rèn luyện kiến thức, bài tập rèn luyện kĩ năng thích hợp cho các đối tượng. - Phối hợp chặt chẽ giữa giáo dục gia đình, nhà trường và xã hội. IV. ĐỐI TƢỢNG, SỐ TIẾT DẠY 1. Đối tƣợng: Đối tượng là những học sinh học yếu kém môn hoá học 8. Hoạt động này diễn ra ngoài giờ chính khóa. Giải pháp này được xây dựng để triển khai trong năm học 2019 - 2020 ở trường THCS Nhân Đạo - Sông Lô - Vĩnh Phúc. 2. Dự kiến số tiết dạy: 01 tiết. V.HỆ THỐNG CÁC DẠNG BÀI TẬP ĐẶC TRƢNG CỦA CHUYÊN ĐỀ: Dạng 1. Lập PTHH dựa trên sơ đồ mô tả PƢHH. - Cho sơ đồ mô tả phản ứng hóa học: Chất tham gia chất tạo thành (sản phẩm) - Quan sát sơ đồ viết CTHH của chất tham gia và sản phẩm - Lập thành PTHH Dạng 2. Lập PTHH dựa trên sơ đồ phản ứng (Cân bằng PTHH). Loại 1: Phƣơng pháp chẵn lẻ: Bƣớc 1: Viết đúng công thức hoá học của các chất tham gia và sản phẩm. 3 VII.HỆ THỐNG CÁC VÍ DỤ, BÀI TẬP CỤ THỂ CÙNG LỜI GIẢI MINH HỌA CHO CHUYÊN ĐỀ Dạng 1. Lập PTHH dựa trên sơ đồ mô tả PƢHH. * Nguyên tắc chung: - Cho sơ đồ mô tả phản ứng hóa học: Chất tham gia chất tạo thành (sản phẩm) - Quan sát sơ đồ viết CTHH của chất tham gia và sản phẩm - Viết thành PTHH. * Ví dụ minh họa: Ví dụ 1: Hình dưới đây là sơ đồ tượng trưng cho phản ứng giữa khí H2 và khí Cl2 tạo ra hiđroclorua (HCl): Cl Cl H H Cl H H Cl Cl H Cl H Hãy viết phương trình hoá học cho phản ứng trên. Giải: PTHH là: H2 + Cl2 2HCl Ví dụ 2: Sơ đồ sau mô phỏng phản ứng tạo ra khí cacbon đioxit như sau: Hãy viết phương trình hoá học cho phản ứng trên. Giải: PTHH là: 2CO + O2 2CO Ví dụ 3: Cho sơ đồ phản ứng hóa học sau: Hãy viết phương trình hoá học cho phản ứng trên. Giải: PTHH là: 2CH4 + 4O2 2CO2 + 4H2O 5 + Sau khi thêm hệ số 2 vào trước CTHH Fe(OH) 3 ta thấy số nguyên tử Fe, O, H ở vế phải đều cố định rồi, nhưng vì sắt có trong duy nhất một công thức hóa học nên ta cân bằng trước. Nếu cân bằng nguyên tố H, O trước thì không xác định được đặt hệ số mấy trước CTHH nào. 2Fe(OH)2 + O2 + H2O ---> 2Fe(OH)3 + Bây giờ ta cân bằng đến nguyên tố H vì số nguyên tử H trong 2Fe(OH) 2 đã cố định nên ta chỉ cần thêm hệ số vào trước công thức hóa học H 2O sao cho số nguyên tử H ở 2 vế bằng nhau. Cuối cùng cân bằng đến nguyên tố O vì O tồn tại ở dạng đơn chất. 1 0 Viết phương trình hoá học: 2Fe(OH) + O + H O t 2Fe(OH) 2 2 2 3 2 Ví dụ 3: Lập phương trình hoá học của phản ứng theo sơ đồ sau: NaOH + Fe2(SO4)3 Fe(OH)3 + Na2SO4 - Ta coi nhóm SO4 và nhóm OH mỗi nhóm như một nguyên tố. - Vậy nhóm SO4 và OH có nhiều nhất và lại không bằng nhau ở hai vế, nên ta cân bằng trước. - Đặt hệ số 3 trước Na2SO4 và NaOH để làm cho số nguyên tử của nhóm SO4 và nhóm OH ở hai vế phương trình bằng nhau. 3NaOH + Fe2(SO4)3 Fe(OH)3 + 3Na2SO4 - Tiếp đó cân bằng số nguyên tử Na, vì một bên 6, một bên 3. Đặt thêm 2 trước NaOH: 2 3NaOH + Fe2(SO4)3 Fe(OH)3 + 3Na2SO4 - Tiếp đó cân bằng số nhóm OH vì một bên 6, một bên 3. Đặt thêm 2 trước Fe(OH)3 : 6NaOH + Fe2(SO4)3 2Fe(OH)3 + 3Na2SO4 Kiểm tra lại số nguyên tử và nhóm nguyên tử hai bên đã bằng nhau. Viết phương trình hoá học: 6NaOH + Fe2(SO4)3 2Fe(OH)3 +3Na2SO4 Ví dụ 4: Cân bằng phương trình hoá học sau. FeS2 + O2 ----> Fe2O3 + SO2 Ta thấy số nguyên tử oxi trong O2 và SO2 là chẵn còn trong Fe2O3 là lẻ vậy cần đặt hệ số 2 trước công thức Fe2O3 Cách làm: FeS2 + O2 ---> 2Fe2O3 + SO2 Tiếp theo ta lần lượt cân bằng số nguyên tử Sắt và Lưu huỳnh. 4FeS2 + O2 ---> 2Fe2O3 + SO2 4FeS2 + O2 ---> 2Fe2O3 + 8SO2 7 5 O2 ---> 2CO2 + H2O C2H2 + 2 Quy đồng mẫu số với mẫu chung là 2 sau đó khử mẫu, ta được: 0 t 2C2H2 + 5O2 2CO2 + 2H2O 0 t Viết phương trình hoá học: 2C2H2 + 5O2 2CO2 + 2H2O Loại 3: Lập phƣơng trình hoá học bằng phƣơng pháp dùng bội số chung nhỏ nhất. * Nguyên tắc chung: Để lập phương trình hoá học theo phương pháp này ta cần thực hiện theo các bước sau: Bƣớc 1: Xác định bội số chung nhỏ nhất của các chỉ số nguyên tố đó trong công thức hoá học. Bƣớc 2: Lấy bội số chung nhỏ nhất lần lượt chia các chỉ số trong từng công thức hoá học để được các hệ số. Sau đó cân bằng các nguyên tố còn lại. Bƣớc 3: Viết phương trình hoá học. Chú ý: Thường bắt đầu từ nguyên tố nào có số nguyên tử nhiều và không bằng nhau ở 2 vế phương trình. *Ví dụ minh họa: Ví dụ 1: Lập phương trình của phản ứng hoá học có sơ đồ sau: o P + O2 t P2O5 Bƣớc 1: - Nguyên tố O có số nguyên tử nhiều và không bằng nhau ở 2 vế. - Ta chọn nguyên tố oxi để cân bằng trước: Bội số chung nhỏ nhất của hai chỉ số 2 và 5 là 10. Bƣớc 2: - Ta lấy 10 : 5 = 2 đặt hệ số 2 trước công thức P2O5. - Ta lấy 10 : 2 = 5 đặt hệ số 5 trước công thức O2 ta được: P + 5O to 2P O 2 2 5 - Tiếp theo, ta cân bằng P: Đặt hệ số 4 trước P, ta được: 4P + 5O to 2P O 2 2 5 Bƣớc 3: 0 t Viết phương trình hoá học: 4P + 5O2 2P 2O 5 0 t Ví dụ 2: Lập PTHH sau: Fe + O2 Fe3O4 Ta nhận thấy vế trái có 1 nguyên tử Fe; 2 nguyên tử O, vế phải có 3 nguyên tử Fe, 4 nguyên tử O -> thêm hệ số 3 trước công thức Fe để cân bằng số nguyên tử Fe. 9 Câu 3: Cho sơ đồ phản ứng: Fe + Cl2 - -> FeCl3 Các hệ số của phương trình lần lượt là: A. 3:2:2 B. 2:3:2 C. 2:1:2 D. 1:1:1 VIII. KẾT QUẢ TRIỂN KHAI CHUYÊN ĐỀ TẠI ĐƠN VỊ NHÀ TRƢỜNG Chuyên đề vừa được xây dựng chuẩn bị triển khai trong năm học 2019 - 2020 Nhân Đạo, ngày 31 tháng 10 năm 2019 Ngƣời viết Lê Hồng Minh 11
Tài liệu đính kèm:
 chuyen_de_lap_phuong_trinh_hoa_hoc.docx
chuyen_de_lap_phuong_trinh_hoa_hoc.docx 9.3 HOA HOC 8- Minh 2019.pdf
9.3 HOA HOC 8- Minh 2019.pdf



