SKKN Xây dựng hệ thống bài tập nhằm phát hiện và bồi duỡng học sinh giỏi hoá học ở truờng trung học phổ thông
Trong xu thế toàn cầu hoá và hội nhập kinh tế quốc tế hiện nay, với sự phát triển như vũ bão của cách mạng khoa học - công nghệ, nhất là công nghệ thông tin và truyền thông; với sự phổ biến của Internet và sự tiến nhanh đến nền kinh tế tri thức thì vấn đề đào tạo, bồi dưỡng nhân tài, đặc biệt là tài năng trẻ có vai trò cực kỳ quan trọng trong tiến trình công nghiệp hóa, hiện đại hóa đất nước. Nhận thức sâu sắc tầm quan trọng của vấn đề nêu trên, Đảng và Nhà nước ta đã thường xuyên quan tâm đến công tác phát hiện, bồi dưỡng và đào tạo nhân tài nói chung và công tác bồi dưỡng học sinh giỏi nói riêng; đầu tư đổi mới hệ thống giáo dục và đào tạo cả về nội dung, phương pháp nhằm nâng cao chất lượng bồi dưỡng nhân tài, có chính sách đãi ngộ đặc biệt đối với các nhà khoa học có công trình nghiên cứu xuất sắc. Nhiều tài năng trẻ đã được bồi dưỡng và phát triển nhanh chóng. Khối trường, lớp chuyên đã có những đóng góp rất lớn trong việc phát hiện, bồi dưỡng nhân tài, tạo nguồn nhân lực chất lượng cao cho đất nước, đồng thời, góp phần tích cực nâng cao chất lượng và thành tích của các kỳ thi học sinh giỏi quốc gia, các cuộc thi Olympic quốc tế về toán, tin học, lý, hoá, sinh và ngoại ngữ. Số học sinh đoạt giải trong các kỳ thi học sinh giỏi quốc gia, quốc tế ngày càng tăng. Chính nguồn nhân lực- nhân tài đó trở thành những nhà khoa học mũi nhọn trong từng lĩnh vực, là nhân tố quyết định đến sự phát triển của một quốc gia. Lĩnh vực hóa học, trong tương lai không xa nền công nghiệp hóa chất, dầu khí của nước ta phát triển vượt bậc, nhanh chóng, nhu cầu về đội ngũ cán bộ, kĩ sư có trình độ kĩ thuật cao trong các lĩnh vực của công nghệ hoá học không thể thiếu.
Để đáp ứng nhu cầu trên cần đẩy mạnh hơn nữa việc phát hiện và bồi dưỡng HSG về hoá học ở trường phổ thông. Đây cũng là nhiệm vụ tất yếu trong công cuộc đổi mới đất nước hiện nay.Các thầy cô giáo bồi dướng HSG phải tự xây dựng cho mình một phương pháp riêng để giúp học sinh vừa giỏi, vừa phát triển được năng lực. Nhằm mục đích này cùng với mong muốn xây dựng cho mình tư liệu dạy học, bồi dưỡng học sinh giỏi tôi đã chọn và nghiên cứu đề tài “ Xây dựng hệ thống bài tập nhằm phát hiện và bồi duỡng học sinh giỏi hoá học ở truờng trung học phổ thông ”.
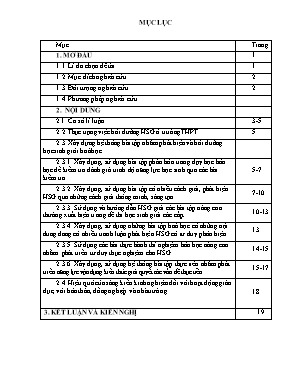
MỤC LỤC Mục Trang 1. MỞ ĐẦU 1 1.1. Lí do chọn đề tài 1 1.2. Mục đích nghiên cứu 2 1.3. Đối tượng nghiên cứu 2 1.4. Phương pháp nghiên cứu 2. NỘI DUNG 2.1. Cơ sở lí luận 3-5 2.2.Thực trạng việc bồi dưỡng HSG ở truờng THPT. 5 2.3. Xây dựng hệ thống bài tập nhằm phát hiện và bồi duỡng học sinh giỏi hoá học. 2.3.1. Xây dựng, sử dụng bài tập phân hóa trong dạy học hóa học để kiểm tra đánh giá trinh độ năng lực học sinh qua các bài kiểm tra 5-7 2.3.2. Xây dựng, sử dụng bài tập có nhiều cách giải, phát hiện HSG qua những cách giải thông minh, sáng tạo. 7-10 2.3.3. Sử dụng và hướng dẫn HSG giải các bài tập nâng cao thường xuất hiện trong đề thi học sinh giỏi các cấp. 10-13 2.3.4. Xây dựng, sử dụng những bài tập hoá học có những nội dung đang có nhiều tranh luận phát hiện HSG có tư duy phản biện. 13 2.3.5. Sử dụng các bài thực hành thí nghiệm hóa học nâng cao nhằm phát triển tư duy thực nghiệm cho HSG. 14-15 2.3.6. Xây dựng, sử dụng hệ thống bài tập thực tiễn nhằm phát triển năng lực vận dụng kiến thức giải quyết các vấn đề thực tiễn. 15-17 2.4. Hiệu quả của sáng kiến kinh nghiệm đối với hoạt động giáo dục, với bản thân, đồng nghiệp và nhà trường. 18 3. KẾT LUẬN VÀ KIẾN NGHỊ 19 1. MỞ ĐẦU 1.1. Lí do chọn đề tài Trong xu thế toàn cầu hoá và hội nhập kinh tế quốc tế hiện nay, với sự phát triển như vũ bão của cách mạng khoa học - công nghệ, nhất là công nghệ thông tin và truyền thông; với sự phổ biến của Internet và sự tiến nhanh đến nền kinh tế tri thức thì vấn đề đào tạo, bồi dưỡng nhân tài, đặc biệt là tài năng trẻ có vai trò cực kỳ quan trọng trong tiến trình công nghiệp hóa, hiện đại hóa đất nước. Nhận thức sâu sắc tầm quan trọng của vấn đề nêu trên, Đảng và Nhà nước ta đã thường xuyên quan tâm đến công tác phát hiện, bồi dưỡng và đào tạo nhân tài nói chung và công tác bồi dưỡng học sinh giỏi nói riêng; đầu tư đổi mới hệ thống giáo dục và đào tạo cả về nội dung, phương pháp nhằm nâng cao chất lượng bồi dưỡng nhân tài, có chính sách đãi ngộ đặc biệt đối với các nhà khoa học có công trình nghiên cứu xuất sắc. Nhiều tài năng trẻ đã được bồi dưỡng và phát triển nhanh chóng. Khối trường, lớp chuyên đã có những đóng góp rất lớn trong việc phát hiện, bồi dưỡng nhân tài, tạo nguồn nhân lực chất lượng cao cho đất nước, đồng thời, góp phần tích cực nâng cao chất lượng và thành tích của các kỳ thi học sinh giỏi quốc gia, các cuộc thi Olympic quốc tế về toán, tin học, lý, hoá, sinh và ngoại ngữ. Số học sinh đoạt giải trong các kỳ thi học sinh giỏi quốc gia, quốc tế ngày càng tăng. Chính nguồn nhân lực- nhân tài đó trở thành những nhà khoa học mũi nhọn trong từng lĩnh vực, là nhân tố quyết định đến sự phát triển của một quốc gia. Lĩnh vực hóa học, trong tương lai không xa nền công nghiệp hóa chất, dầu khí của nước ta phát triển vượt bậc, nhanh chóng, nhu cầu về đội ngũ cán bộ, kĩ sư có trình độ kĩ thuật cao trong các lĩnh vực của công nghệ hoá học không thể thiếu. Để đáp ứng nhu cầu trên cần đẩy mạnh hơn nữa việc phát hiện và bồi dưỡng HSG về hoá học ở trường phổ thông. Đây cũng là nhiệm vụ tất yếu trong công cuộc đổi mới đất nước hiện nay.Các thầy cô giáo bồi dướng HSG phải tự xây dựng cho mình một phương pháp riêng để giúp học sinh vừa giỏi, vừa phát triển được năng lực. Nhằm mục đích này cùng với mong muốn xây dựng cho mình tư liệu dạy học, bồi dưỡng học sinh giỏi tôi đã chọn và nghiên cứu đề tài “ Xây dựng hệ thống bài tập nhằm phát hiện và bồi duỡng học sinh giỏi hoá học ở truờng trung học phổ thông ”. 1.2. Mục đích nghiên cứu - Tìm hiểu cơ sở lí luận của đề tài. - Bài tập nhằm phát hiện học sinh giỏi môn Hoá học. - Xây dựng, sử dụng bài tập Hóa Học Bồi dưỡng Học sinh giỏi nhằm phát triển năng lực tư duy học sinh. 1.3. Đối t ượng nghiên cứu: - Đối t ượng nghiên cứu : Bồi duỡng học sinh giỏi Hóa THPT tham dự kì thi học sinh giỏi các cấp( chủ yếu là HSG cấp tinh). 1.4. Phư ơng pháp nghiên cứu - Nghiên cứu cơ sở lí luận của lí thuyết . - Nghiên cứu tài liệu, sách giáo khoa, sách giáo viên, sách bài tập, sách tham khảo, các đề thi học sinh giỏi Hóa các cấp các năm . - Thực nghiệm: Từ thực nghiệm giảng dạy cho học sinh ở nhiều năm học với nhiều lớp học sinh thông qua các bài kiểm tra qua các kỳ thi học sinh giỏi và quá trình ôn tập cho học sinh giỏi. 2. NỘI DUNG 2.1. Cơ sở lí luận. 2.1.1. Những phẩm chất và năng lực tư duy của một học sinh giỏi hoá học Theo PGS. Bùi Long Biên (Đại học Bách Khoa):“Học sinh giỏi hoá học phải là nguời nắm vững bản chất hiện tuợng hoá học, nắm vững các kiến thức cơ bản đã đuợc học để giải quyết một hay nhiều vấn đề mới trong các kì thi đưa ra” [1] Theo PGS.TS. Cao Cự Giác ( Đại học Vinh): Một học sinh giỏi hoá học phải hội đủ “ba có” - Có kiến thức cơ bản tốt, thể hiện nắm vững kiến thức cơ bản một cách sâu sắc có hệ thống. - Có khả năng tư duy tốt và tính sáng tạo cao: trình bày và giải quyết vấn đề một cách linh hoạt, rõ ràng, khoa học và tối ưu. - Có khả năng thực hành thí nghiệm tốt: Hoá học là khoa học vừa lí thuyết vừa thực nghiệm, không thể tách rời lý thuyết với thực nghiệm. Phải biết vận dụng lý thuyết để điều khiển thực nghiệm và từ thực nghịêm kiểm tra các vấn đề của lý thuyết, hoàn thiện lý thuyết. Theo các tài liệu về tâm lý học, phuơng pháp dạy học hoá học, những bài viết về vấn đề học sinh giỏi hoá học thì những phẩm chất và năng lực tư duy mà học sinh giỏi hoá học vần có là: Năng lực tiếp thu kiến thức Năng lực suy luận logic Năng lực đặc biệt Năng lực lao động sáng tạo Năng lực kiểm chứng Năng lực thực hành. [1] Vì vậy, giáo viên dạy cần quan sát để phát hiện đuợc học sinh giỏi môn hoá học từ những phẩm chất và năng lực tư duy quan trọng sau: - Phải có kiến thức cơ bản vững vàng, sâu sắc, có hệ thống. Từ những kiến thức cơ sđuợc, một học sinh giỏi hoá cần biết vận dụng linh hoạt các kiến thức cơ bản vào giải quyết các vấn đề đặt ra, biết áp dụng kiến thức cũ trong các tình huống mới. - Học sinh giỏi cần phải có năng lực tư duy sáng tạo. Nguời học phải biết phân tích tổng hợp và so sánh, khái quát hoá , có khả năng sử dụng các các phuơng pháp phán đoán mới: Quy nạp, suy diễn và loại suy. - Kĩ năng thực hành tốt: biết nêu ra những dự đoán, lí luận cho các hiện tuợng xảy ra trong thực tế và biết cách dùng thực nghiệm để kiểm chứng lại những suy đoán trên. - Có năng lực suy nghĩ độc lập tự nhìn thấy vấn đề và phát hiện đuợc vấn đề , đặt vấn đề và giải quyết vấn đề, kiểm tra và đánh giá đuợc cách giải quyết của bản thân, phản biện đuợc cách giải quyết vấn đề của nguời khác. - Có năng lực suy nghĩ linh hoạt, sáng tạo, phát hiện đuợc mối quan hệ khăng khít giữa những sự kiện có trong thực nghiệm, trong bài tập hoặc trong thực tế sản xuất, đời sống để tìm ra phuơng pháp đúng, hợp lí, độc đáo để giải quyết vấn đề dặt ra. [1] 2.1.2. Các thao tác tư duy trong dạy học học sinh giỏi môn hoá học truờng phổ thông. Để nắm vững bản chất, hiện tuợng hoá học cũng như vận dụng kiến thức giải quyết những vấn đề mới, một học sinh đặc biệt là học sinh giỏi cần phải có năng lực tư duy sáng tạo. Nguời học phải biết phân tích tổng hợp và so sánh, khái quát hoá , có khả năngỷư dụng các các phuơng pháp phán đoán mới: Quy nạp, suy diễn và loại suy. 2.1.3. Bài tập hoá học và phát triển tư duy của học sinh. Để phát hiện học sinh giỏi và bồi duỡng học sinh giỏi môn hoá học, việc xây dựng hệ thống bài tập có vấn đề là một khâu vô cùng quan trọng. Kinh nghiệm nhiều năm ôn luyện học sinh giỏi, tôi đã rút ra một số cách sử dụng bài tập hoá học thông qua đó phát hiện đuợc học sinh giỏi: - Sử dụng bài tập phân hóa trong dạy học hóa học để kiểm tra đánh giá trinh độ năng lực học sinh qua các bài kiểm tra - Sử dụng bài tập có nhiều cách giải, phát hiện HSG qua những cách giải thông minh, sáng tạo - Thường xuyên tạo tình huống có vấn đề mới, lạ trong dạy học, kích thích tư duy sáng tạo của HSG 2.1.4. Các biện pháp bồi duỡng học sing giỏi. - Hướng dẫn HSG tìm hiểu những vấn đề khó, vượt quá chương trình THPT - Hướng dẫn HSG giải các bài tập nâng cao thường xuất hiện trong đề thi học sinh giỏi các cấp. - Hướng dẫn HSG phát triển tư duy phản biện qua những nội dung hóa học đang có nhiều tranh luận - Hướng dẫn HSG phát triển tư duy thực nghiệm qua các bài thực hành thí nghiệm hóa học nâng cao - Hướng dẫn học sinh rèn luyện năng lực vận dụng kiến thức giải quyết các vấn đề thực tiễn 2.2.Thực trạng việc bồi dưỡng học sinh giỏi ở truờng THPT. “Bồi dưỡng nhân tài” nói chung và bồi dưỡng học sinh giỏi Hóa học nói riêng là nhiệm vụ tất yếu trong công cuộc đổi mới đất nước hiện nay. Bởi đội ngũ HSG này trong tuơng lai sẽ là lực luợng nòng cốt xây dựng và phát triển đất nuớc. Tuy nhiên công tác bồi dưõng học sinh giỏi đặc biệt ở các truờng phổ thông nông thôn còn nhiều khó khăn: - Chưa có tài liệu bồi duỡng học sinh giỏi chính thống, kiến thức rộng - Phụ huynh học sinh chưa thực sự hiểu rõ tầm quan trọng của việc bồi duỡng học sinh giỏi - Điểm xuất phát của học sinh còn thấp, đối tuợng học sinh hội đủ các phẩm chất và năng lực của một học sinh giỏi hoá còn rất ít. Đây cũng là trăn trở của mỗi giáo viên khi đứng đội tuyển, vì vậy tôi mạnh dạn nêu lên một số kinh nghiệm phát hiện và bồi duỡng học sinh giỏi môn Hoá học. 2.3. Xây dựng hệ thống bài tập nhằm phát hiện và bồi duỡng học sinh giỏi hoá học. 2.3.1. Xây dựng, sử dụng bài tập phân hóa trong dạy học hóa học để kiểm tra đánh giá trinh độ năng lực học sinh qua các bài kiểm tra - Tuyển chọn và xây dựng một số bài tập có các câu hỏi chứa 4 mức độ nhận thức biết, hiểu, vận dụng, sáng tạo trong đó chú trọng các mức độ vận dụng và sáng tạo. - Sử dụng các bài tập này trong dạy học cũng như các bài kiểm tra định kì, chọn và sàng lọc đội tuyển. - Phân tích đánh giá từng bài kiểm tra của các em để phân loại và tuyển chọn các em thường xuyên trả lời được các câu hỏi ở mức độ vận dụng và sáng tạo vào đội tuyển. Ví dụ 1: Cho nguyên tử của nguyên tố X có cấu hính electron: 1s22s22p63s23p64s2 1 Nêu vị trí (ô nguyên tố, chu kì, nhóm) của nguyên tố X trong BTH 2. X là nguyên tố gì? (kim loại, phi kim hay khí hiếm). Xu hướng của X trong các phản ứng hoá học là gì ? 3. Nguyên tử của nguyên tố Y có tổng số hạt mang điện nhiều hơn số hạt mang điện của X là 30 hạt. Xác định vị trí của Y trong BTH, giải thích 4. Trong tự nhiên Y có 2 đồng vị 35Y và 37Y có thành phần phần trăm về số nguyên rử lần lượt là 75% và 25%. Tính % về khối lượng của 35Y trong KYO3 ( Cho nguyên tử khối K = 39, Y= 35,5, O=16) Phân tích bài tập Mức độ biết Từ cấu hình X có Z = 20 Vị trí của Xtrong BTH: ô thứ 20, chu kì 4, nhóm IIA Mức độ hiểu X là kim loại vì có 2 e ở lớp ngoài cùng X có xu hướng nghường e trong các phản ứng hoá học để tạo thành ion dương có cấu hình bền vững giống khí hiếm: X → X2+ + 2e Mức độ vận dụng Ta có phương trình: 2ZY – 2ZX = 30→ ZY = 35 Y (Z =35):1s22s22p63s23p63d10 4s24p5 Vị trí của Y trong BTH: ô thứ 35 vì Z = 35 Chu kì 4 vì có 4 lớp e Nhóm VIIA vì nguyên tố p và có 7 e lớp ngoài cùng Mức độ sáng tạo Gỉa sử số mol của KYO3 là 1 mol → số mol của Cl là 1 mol → số mol của 35Y là 0,75 mol→ % m35Y = Ví dụ 2: Sản xuất amoniac trong công nghiệp theo phương trình phản ứng sau ( điều kiện thích hợp): N2(k) + 3H2(k) 2NH3 (k) 1.Xác định sự thay đổi số oxihóa của các nguyên tố trong phản ứng trên? 2.Phản ứng trên có phải phản ứng oxihóa khử hay không ? 3.SO2 sinh ra từ quá trình sản xuất công nghiệp là chất độc hại cho môi trường ,có cách nào để loại bỏ NH3 trong không khí. 4.Để diều chế được 1 tấn NH3 cần bao nhiêu m3 không khí biết N2 chiếm 80% thể tích không khí, hiệu suất của phản ứng đạt 45% 5. Tại 4000C, P = 10atm phản ứng N2(k) + 3H2(k) 2NH3 (k) có Kp = 1,64 ´10-4. Tìm % thể tích NH3 ở trạng thái cân bằng, giả thiết lúc đầu N2(k) và H2(k) có tỉ lệ số mol theo đúng hệ số của phương trình.[4] Phân tích bài tập: 1. Mức độ biết: HS xác định được số oxi hóa của các nguyên tố trong phản ứng N20(k) + 3H20 (k) 2N-3H3+1 (k) 2. Mức độ biết: HS dựa vào sự thay đổi số oxi hóa của các nguyên tố kết luận phản ứng trên là phản ứng oxi hóa- khử. 3.Mức độ hiểu: Vì NH3 có tính bazo nên phun HCl thì NH3 tác dụng với HCl tạo thành muối amoni NH4Cl 4. Mức độ vận dụng: N2(k) + 3H2(k) 2NH3 (k) 22,4 m3 34 kg ? 1000kg m3 5. Mức độ sáng tạo: Theo PTHH: Þ Theo gt: P+ P + P = 10 Þ P+ 4P = 10 Và Ta có: Kp = = = 1,64 ´10-4 Þ 6,65´10-2. Giải pt cho: 6,65 ´10-2(P)2 + 4P - 10 = 0 Þ P= 2,404 và P= - 62,55 < 0 Vậy, P= 2,404 Þ P= 10 - 4P = 0,384 atm chiếm 3,84% 2.3.2. Xây dựng, sử dụng bài tập có nhiều cách giải, phát hiện HSG qua những cách giải thông minh, sáng tạo Xây dựng và sử dụng bài tập có nhiều cách giải, trong đó có cách giải hay, nhanh và sáng tạo ít nhất là 2 cách trong đó có cách giải nhanh, sáng tạo. Thông qua đó phát hiện được những học sinh có khả năng sáng tạo trong cách giải. Ví dụ 1: Cho 11,2(g) Fe tan hoàn toàn vào dung dịch chứa x (mol) HNO3. Sau phản ứng thu được dung dịch Y chứa 37,24 (g) muối ( không có NH4NO3) và V (lít) khí NO ( sản phẩm khử duy nhất của N+5). Tìm x và V Lời giải: Cách 1: Cách giải thông thường Vì muối này chưa thể biết là muối sắt (II) hay muối sắt (III) hoặc cả 2 loại nên thông thường học sinh sẽ xét các trường hợp rồi loại dần: + Nếu lên muối sắt (II) ta có : Fe0 Fe+2 + 2e 0,2mol 0,2 0,4 mol Vậy mmuối sắt (II) = 0,2 .180 = 36 (g) loại + Nếu là muối sắt (III) tương tự ta có: Fe0 Fe+3 + 3e mmuối sắt (III) = 0,2.242 = 48,4(g) Loại Vậy đó là hỗn hợp muối sắt (II) và muối sắt (III): Gọi số mol Fe(NO3)2 và Fe(NO3)3 lần lượt là a và b. Bảo toàn nguyên tố Fe ta có: a + b = 0,2 Khối lượng muối là : 180a + 242b = 37,24 Giải hệ phương trình ta có Ta lại có quá trình nhường nhận e : Fe0 Fe+2 + 2 e 0,18mol 0,36mol Fe0 Fe+3 + 3 e 0,02mol 0,06mol N+5 + 3e N+2 Áp dụng bảo toàn e ta có nNO = = 0,14mol. V = 3,136 (lít) Áp dụng bảo toàn nguyên tố N ta có x = nHNO = 0,14 + 0,36+0,06 = 0,56 Cách 2: Cách sử dụng phương pháp số oxi hóa trung bình Ta có quá trình tổng quát: Fe0 Fe+ + e 0,2mol 0,2(mol) N+5 + 3e N+2 0,2 Theo bảo toàn nguyên tố Fe ta có nFe = nmuối = 0,2mol. Hay muối có dạng: Fe(NO3) có khối lượng là: 0,2( 56 + 62 ) = 37,24. = 2,1 Vậy số mol của NO là : = 0,14 mol V = 3,136 (lít) Áp dụng bảo toàn nguyên tố N có : x = nHNO = 0,2 + 0,14 = 0,56 (mol) Cách giải thứ 2 nhanh hơn, tổng quát hơn thể hiện sự sáng tạo Ví dụ 2: Cho 0,87 gam hỗn hợp gồm Fe, Cu và Al vào bình đựng 300 ml dung dịch H2SO4 0,1M. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,32 gam chất rắn và có 448 ml khí (đktc) thoát ra. Thêm tiếp vào bình 0,425 gam NaNO3, khi các phản ứng kết thúc thì thể tích khí NO (đktc, sản phẩm khử duy nhất) tạo thành và khối lượng muối trong dung dịch là A. 0,224 lít và 3,750 gam. B. 0,112 lít và 3,750 gam. C. 0,112 lít và 3,865 gam. D. 0,224 lít và 3,865 gam. [5] Giải: Cho hỗn hợp (Fe, Cu và Al ) tác dụng với dung dịch H2SO4 0,1M ban đầu → H+ dư→ Fe và Al phản ứng hết → chất rắn sau phản ứng chỉ có Cu →mCu =0,32 gam→nCu = Gọi số mol của Al và Fe lần lượt là x, y Al0 → Al3+ + 3e 2 H+ + 2.1e → H2 x 3.x mol 0,04 0,04 0,02 mol Fe0 → Fe+2 + 2e y 2.y mol Ta có hệ phương trình: → Hỗn hợp sau phản ứng gồm : Cu, Fe2+, Al3+, SO42-, H+. Cho tiếp NaNO3 vào thì Cu, Fe2+ bị oxh bởi NO3-/H+ .Do tính khử của Cu > Fe2+ nên Cu bị oxh trước Cách giải thông thường Cách 1: Viết pt ion thu gọn: 3 Cu + 8 H+ + 2 NO3- → 3 Cu2+ + 4 H2O + 2 NO nbđ 0,005 0,02 0,005 npư 0,005 1/75 1/300 1/300 ndư 0 1/150 1/600 Lập tỉ lệ: nên Cu phản ứng hết, H+ và NO3- dư Có phản ứng sau xảy ra: 3Fe2+ + 4 H+ + NO3- → 3Fe3+ + 2 H2O + NO 0,005 1/150 1/600 0,005/3 lập tỉ lệ ta có: → Fe2+ , H+ , NO3- phản ứng vừa đủ với nhau Vậy: NNO = 1/300 + 0,005/3 = 0,005 mol → VNO = 0,112 (lít) Dung dịch sau phản ứng gồm : Cu2+ , Fe3+, Al3+, SO42-, Na+ Khối lượng muối thu được: 0,87 + 0,03.96 + 0,005.23 = 3,865 gam Cách 2: áp dụng định luật bảo toàn e Cu0 → Cu+2 + 2 e 4H+ + NO3- +3 e NO + 2H2O 0,005 0,01 0,02 0,005 0 015 0,005 Fe+2 → Fe+3 + 1e 0,005 0,005 Vậy ne nhường max = ne nhận max = 0,015 mol → ne trao đổi = 0,015 mol VNO = 0,112 (lít) Dung dịch sau phản ứng gồm : Cu2+ , Fe3+, Al3+, SO42-, Na+ Khối lượng muối thu được: 0,87 + 0,03.96 + 0,005.23 = 3,865 gam → Đáp án C Cách giải thứ hai hay và sáng tạo và tổng quát hơn cách 1 2.3.3. Sử dụng và hướng dẫn HSG giải các bài tập nâng cao thường xuất hiện trong đề thi học sinh giỏi các cấp. - Lựa chọn, hướng dẫn học sinh giải các bài tập nâng cao thường xuất hiện trong đề thi học sinh giỏi các cấp. - giáo viên nghiên cứu đề thi học sinh giỏi các năm để phân dạng những bài tập thường có trong đề thi. - giáo viên siêu tầm, tổng hợp những bài tập cùng dạng từ các nguồn tài liệu khác nhau ( tập đề học sinh giỏi các năm, tài liệu nâng cao, bồi dưỡng học sinh giỏi )và hướng dẫn học sinh cách giải tổng quát, những biến dạng có thể có, những sai lầm thường gặp của học sinhsau đó học sinh áp dụng làm các bài tập cụ thể - Kiểm tra, đánh giá hoạt động học của học sinh. Ví dụ 1: Trong đề thi học sinh giỏi thường có bài toán về HNO3, giáo viên siêu tầm tổng hợp và phân dạng các bài toán nâng cao về HNO3 và hướng dẫn học sinh giỏi giải các bài toán cụ thể ( giáo viên lưu ý cachs giải hay, sáng tạo đồng thời chú ý những sai lầm HS thường mắc phải...). Ví dụ: 1. Hòa tan hoàn toàn 25,3 gam hỗn hợp X gồm Mg, Al, Zn bằng dung dịch HNO3. Sau khi phản ứng kết thúc thu được dung dịch Y và 4,48 lít (đktc) khí Z (gồm hai hợp chất khí không màu) có khối lượng 7,4 gam. Cô cạn dung dịch Y thu được 122,3 gam hỗn hợp muối. Tính số mol HNO3 đã tham gia phản ứng. [6] Huớng dẫn giải: Z không màu => không có NO2. Các khí là hợp chất => không có N2. => Hai hợp chất khí là N2O và NO. Theo đề ta có: Hỗn hợp muối gồm Mg(NO3)2, Zn(NO3)2, Al(NO3)3 và có thể có NH4NO3. Gọi số mol của NH4NO3 là x mol (x0). Ta có các quá trình nhận electron: 10H+ + 2NO 3- + 8e N2O + 5H2O 1 0,1 0,5 (mol) 4H+ + NO 3- + 3e NO + 2H2O 0,4 0,1 0,2 (mol) 10H+ + 2NO 3- + 8e NH4NO3 + 3H2O 10x x 3x (mol) => ; Theo phương pháp bảo toàn khối lượng ta có: 25,3 + 63(1,4+10x) = 122,3 + 7,4 + 18(0,7+3x) => x=0,05 => nHNO3 = 1 + 0,4 + 10.0,05 = 1,9 mol. 2. Hỗn hợp bột A gồm 3 kim loại Mg, Zn, Al. Khi hoà tan hết 7,539g A vào 1lít dung dịch HNO3 thu được 1lít dung dịch B và hỗn hợp khí D gồm NO và N2O. Thu khí D vào bình dung tích 3,20lít có chứa sẵn N2 ở 00C và 0,23atm thì nhiệt độ trong bình tăng lên đến 27,30C, áp suất tăng lên đến 1,10atm, khối lượng bình tăng thêm 3,720g. Nếu cho 7,539g A vào 1lít dung dịch KOH 2M thì sau khi kết thúc phản ứng khối lượng dung dịch tăng thêm 5,718g. Tính thành phần phần trăm khối lượng mỗi kim loại trong A. [7] Hướng dẫn: Giả sử trong 7,539 A có ( Mg: x mol; Zn: y mol; Al: z mol) Phương trình hoà tan: 3M + 4n HNO3 ® 3M (NO3)n + nNO + 2nH2O (1) 8M + 10n HNO3 ® 8 M(NO3)n + nN2O + 5n H2O (2) với Mg: n = 2, Zn: n = 2, Al: n = 3 ( có thể viết từng phản ứng riêng biệt) - Tính tổng số mol hỗn hợp khí C: Nếu đưa toàn bộ bình khí (chứa hỗn hợp C và N2) về 00C thì áp suất khí là: p tổng = pc = 1 atm - 0,23 atm = 0,77 atm nc = + Tính số mol mỗi khí trong hỗn hợp C: 0,11 mol C NO : a mol 3,720 g N2O: b mol a + b = 0,11 mol a = 0,08 mol NO 30 a + 44 b = 3,720g b = 0,03 mol N2O + Số electron do NO3- nhận từ hỗn hợp A: NO3- + 3e ® NO 0,24 mol ¬ 0,08 mol 0,24 + 0,24 = 0,48 mol electron 2NO3- + 8e ® N2O 0,24 mol ¬ 0,03 mol + Số electron do A nhường: 2x + 2y + 3z = 0,48 (mol electron ) + Khi cho 7,539 A vào 1 lít dung dịch KOH 2M Zn + 2KOH ® K2ZnO2 + H2 2Al + 2KOH + 2H2O ® 2KAlO2 + 3H2 + Biện luận dư KOH: nAl < nZn < nKOH = 2 mol > 0,28 mol dư KOH + Độ giảm khối lượng dung dịch: y (65,38 – 2,016) + z (26,98 -3,024) = 5,718 + Từ đó có hệ phương trình đại số: 24,30 x + 65,38 y + 26,98 z = 7,539 x = 0,06 mol Mg 2x + 2y + 3z = 0,48 y = 0,06 mol Zn 63,364 y + 23, 956 z = 5,718 → z = 0,08 mol Al Thành phần khối lượng A: Mg : 0,06 mol x 24,30g/ mol = 1,458g ® 19
Tài liệu đính kèm:
 skkn_xay_dung_he_thong_bai_tap_nham_phat_hien_va_boi_duong_h.doc
skkn_xay_dung_he_thong_bai_tap_nham_phat_hien_va_boi_duong_h.doc



